近日,江南大学粮食发酵与食品生物制造国家工程研究中心邓禹教授团队在酶催化领域权威期刊《ACS Catalysis》(IF 13.7)在线发表了最新研究成果“Rational Design of the Substrate Tunnel of β-ketothiolase Reveals a Local Cationic Domain Modulated Rule that Improves the Efficiency of Claisen Condensation”(全文链接为https://doi.org/10.1021/acscatal.3c01426)。该研究基于β-酮硫解酶Tfu_0875β-酮硫解酶Tfu_0875的晶体结构,解析其催化机制,理性设计底物通道,提出了提高β-酮硫酶酶活性的普适性改造原则。
在生物合成途径中,形成新的碳-碳键是化合物衍生化中最重要的一步,因其可以从简单的起始分子生成复杂的有机化合物。硫解酶催化的Claisen缩合可以催化生物体形成碳-碳键,从而构建多种多样的化合物碳骨架。在催化过程中,硫解酶的底物通道对底物的结合和缩合反应起着重要作用,可以直接影响酶活。然而,底物通道如何影响β-酮硫酶的催化机制尚不清楚,这限制了底物通道的理性工程设计以提高酶的性能。因此,探索底物通道的普适性调控机制,有助于建立一种可靠、通用的提高β-酮硫酶性能工程方法,从而广泛应用于碳-碳键的形成。
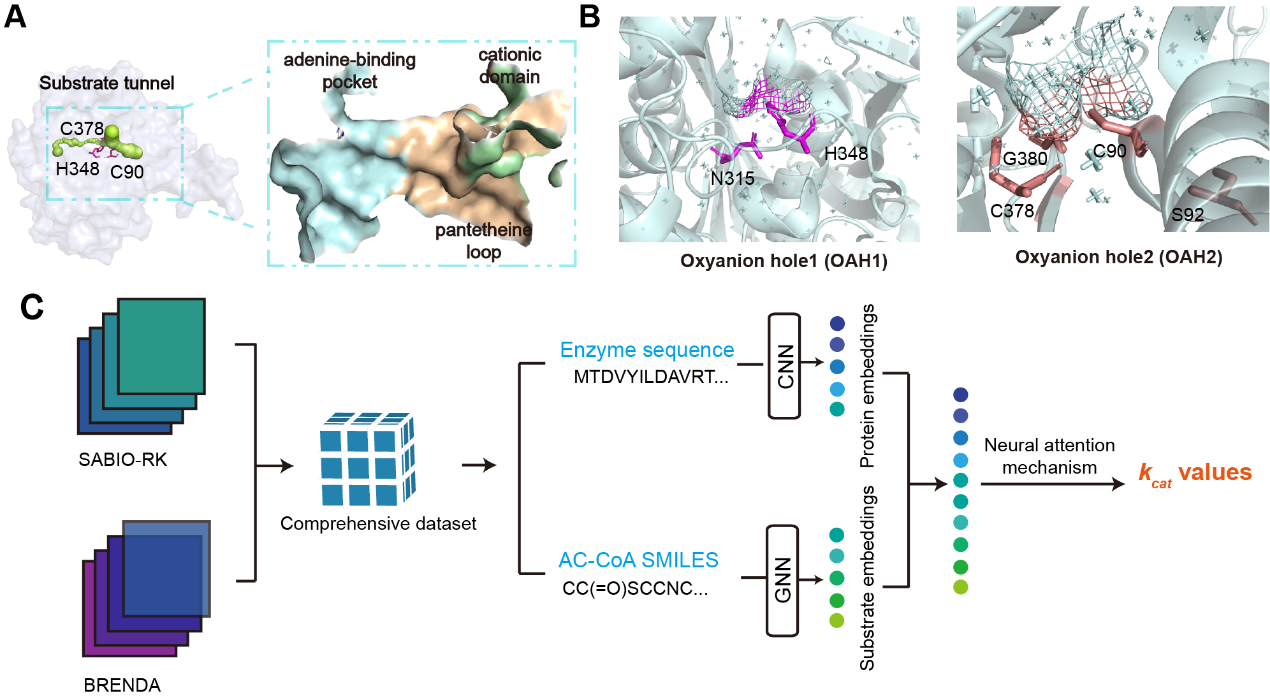
该研究解析了来自褐色喜热裂孢菌的一种耐热的β-酮硫解酶Tfu_0875的晶体结构。该酶具有Cys-His-Cys催化三联体,主要由阳离子结构域、腺嘌呤结合口袋和泛酰巯基乙胺环构成狭窄的底物通道。Tfu_0875的活性结构域含有氧阴离子空穴(OAHs)来稳定底物的过渡态。然后聚焦于底物通道,通过深度学习方法(DLKcat)预测突变体们的kcat来筛选底物通道内酶活提高的突变体。
经筛选后发现Tfu_0875阳离子域的突变体L163H酶活提高最显著,比Tfu_0875提高了313%。L163H的咪唑基团比活性中心His348的咪唑基团更接近底物乙酰辅酶A的Cα原子,且Tfu_0875L163H的G147可以与L163H形成氢键,这与Tfu_0875中的活性中心H348和N315 (OAH1)相同。同时测量Tfu_0875H348A和Tfu_0875L163H/H348A的相对酶活性,结果表明Tfu_0875L163H/H348A的相对酶活性比Tfu_0875H348A高1.79倍,因此认为突变体L163H可以发挥与His348相同的作用,作为氢键供体帮助锚定底物。经过分子动力学模拟发现,Tfu_0875L163H产生的氢键数量明显高于Tfu_0875,说明Tfu_0875L163H与底物乙酰辅酶A之间存在更强的相互作用,可以更快锚定底物乙酰辅酶A,间接缩短反应时间。此外,当L163变为H163时,阳离子域的体积从69.18 Å3增大到81.15 Å3。
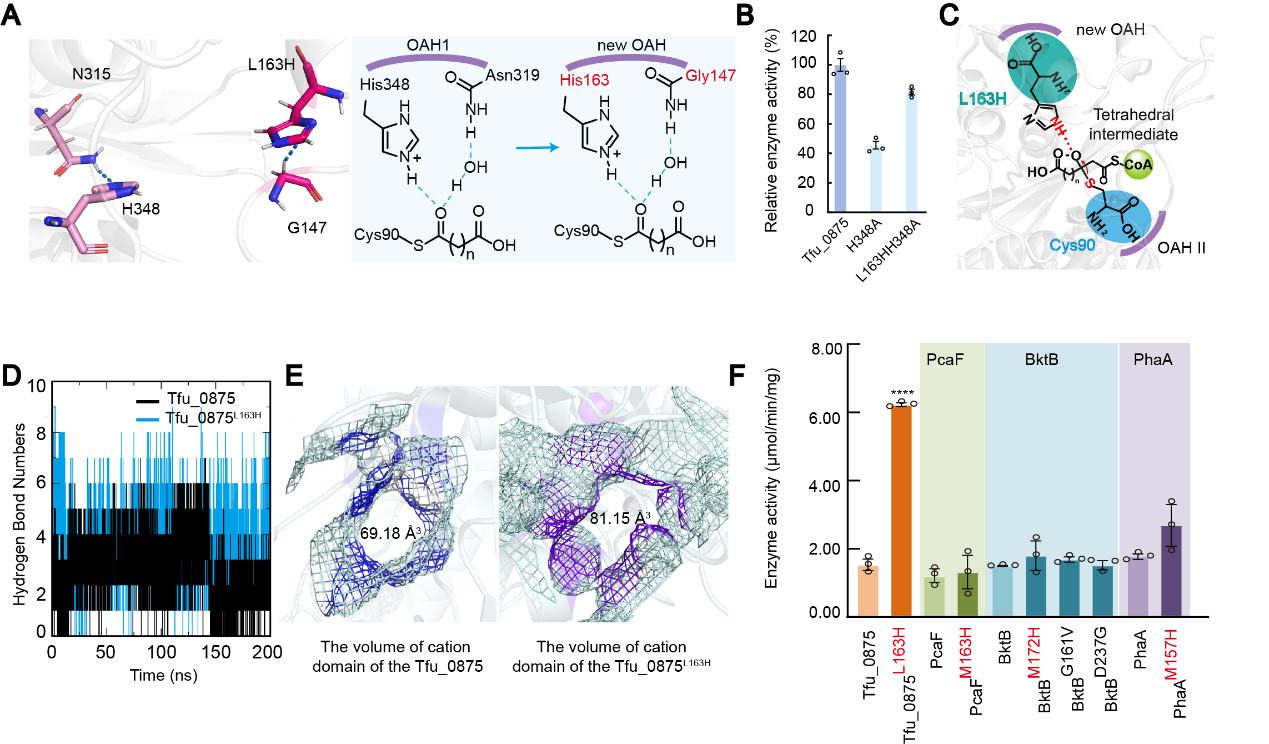
根据上述分析,该研究揭示了一个局部阳离子域设计规则(LCDMR)。将loop区域和三明治拓扑结构的α5螺旋交界处的非保守残基突变为组氨酸,通过:(1)增加阳离子结构域的体积,为底物提供更宽的反应空间;(2)增加周围残基与底物的氢键相互作用,加速Claisen缩合反应;(3)与活性中心H348功能相似,从而锚定底物稳定四面体中间体。这一规律对提高其他β-酮硫酶的酶活性具有普遍适用性。
上述研究工作中,江南大学19级博士研究生刘丽霞为论文的第一作者,邓禹教授和周胜虎副研究员为论文的共同通讯作者。此研究工作得到了国家重点研发计划(2022YFC2104600)、江苏省杰出青年基金(BK20220089)和天津市合成生物技术创新能力提升项目(TSBICIP-KJGG-015)的资助。
