近期,我校生物工程学院周哲敏教授团队在消除酶“活性-热稳定性Trade-off”现象的研究方面取得重要进展,研究成果“Counteraction of stability-activity trade-off of Nattokinase through flexible region shifting”正式发表于Food Chemistry (IF=8.8) (https://doi.org/10.1016/j.foodchem.2023.136241)。
“活性-热稳定性Trade-off”现象长期以来是改造获取高性能酶的限制因素,尽管对该现象的研究由来已久,但是其背后的分子机制,尤其是蛋白质结构动力学变化所起到的作用始终没有得到良好解决。纳豆激酶是一种丝氨酸蛋白酶,其由于高效的纤维蛋白降解特性受到关注并在保健品领域广泛应用。但是,野生型纳豆激酶稳定性较差,严重影响产品稳定性,而传统单一策略提升稳定性的同时往往会带来酶活性降低。
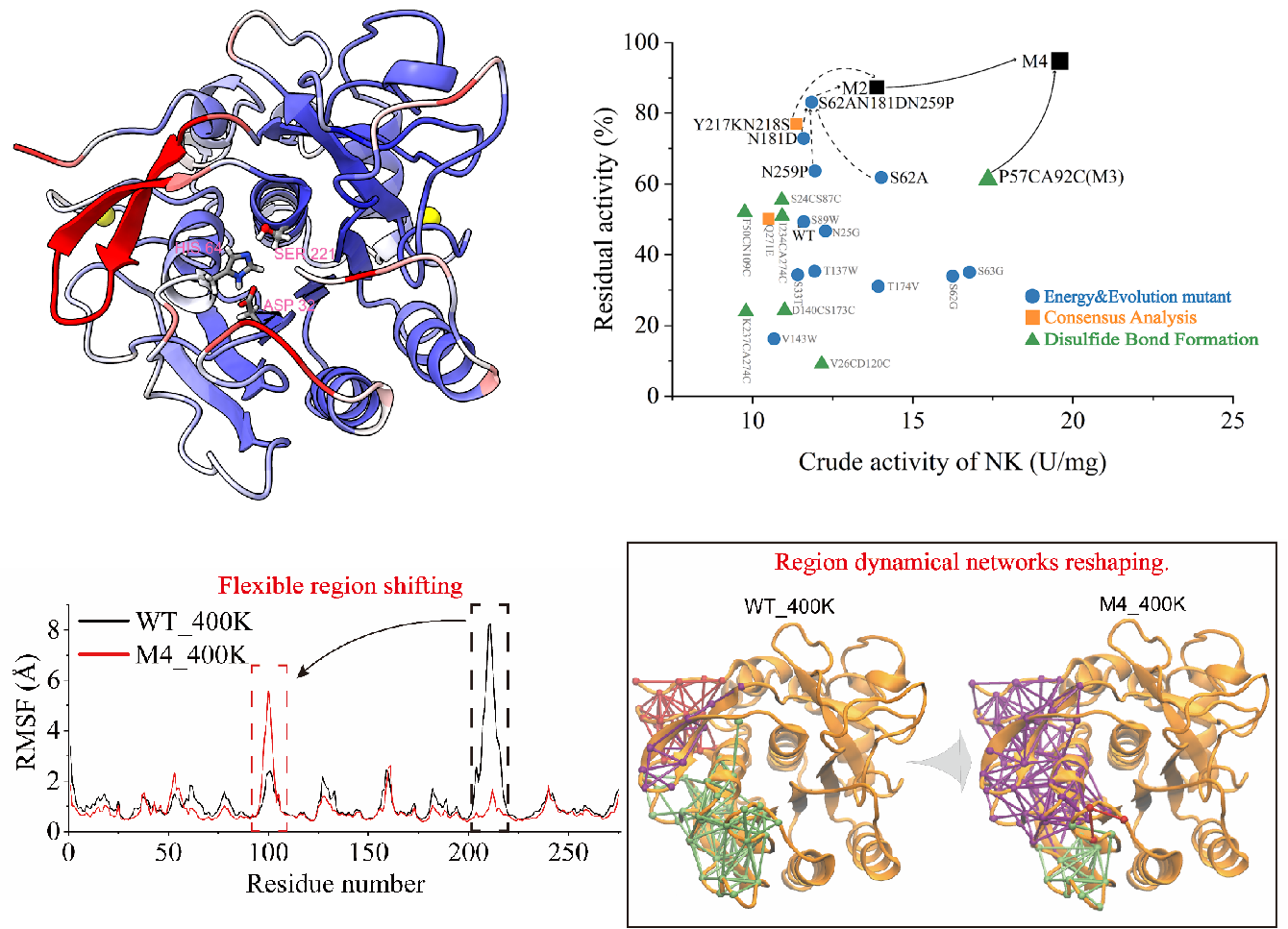
针对这一问题,该研究首先采用常规分子动力学模拟对野生型纳豆激酶在300K与400K条件下分别进行了动力学模拟。结果显示,纳豆激酶较多的Loop结构是其主要的热敏感区。针对热敏感区,进行了包含折叠自由能预测设计、二硫键设计和序列共识设计的多策略改造。经迭代优化,最终获得组合突变M4,其在55℃下半衰期较野生型提升了20.7倍,同时比酶活也较野生型提升2倍。经的RMSF、Rg、DCCM分析,以及元动力学模拟(Metadynamics MD)发现:M4的结构的整体柔性与野生型无明显差别,但其局部柔性区发生转移。进一步的动力学网络分析显示:该柔性区转移是由残基间动力学网络的重构驱动的。以上研究不仅获得了一个高性能纳豆激酶突变体,更重要的是,消除“活性-热稳定性Trade-off”新机制的发现对于其他高性能酶的设计与改造提供了借鉴与指导。
生物工程学院20级博士生罗杰为该论文第一作者,韩来闯助理研究员和周哲敏教授为该论文的共同通讯作者。上述研究工作得到了国家自然科学基金(32201034)、江苏省自然科学基金(BK20210470)、中国博士后科学基金(2021M701461)等项目资助。
