近期,我校生物工程学院陈坚院士团队在毕赤酵母合成血红素结合蛋白方面取得重要进展,研究成果“Biosynthesis of high-active hemoproteins by the efficient heme-supply Pichia Pastoris chassis”正式发表于Advanced Science (IF = 15.10) (http://doi.org/10.1002/advs.202302826)。
血红素结合蛋白是一大类以血红素为辅基的具有重要生理功能的蛋白或酶,包括血红蛋白(Hb)、肌红蛋白(Mb)、细胞色素P450酶、过氧化氢酶和过氧化物酶等。目前,这些血红素结合蛋白/酶已经应用于食品、医药、高细胞密度发酵以及生物催化剂等多个领域。其中,猪肌红蛋白(P-Mb)与肉的颜色以及风味密切相关;大豆血红蛋白(S-Hb)已作为颜色添加剂用于人造肉的生产;透明颤菌血红蛋白(V-Hb)具有很强的氧运输能力,常用于代谢工程领域以促进细胞生长和产物合成; P450-BM3单加氧酶可以实现区域选择性和立体选择性羟基化催化,常用作药物、天然产物和化学中间体合成的全细胞生物催化剂。
随着食品工业、高细胞密度发酵以及高附加值化合物的合成对这些血红素结合蛋白/酶的需求不断增长,有必要开发一个可以高效合成高生物活性血红素结合蛋白/酶的微生物平台。尽管P-Mb与S-Hb已可在大肠杆菌(E. coli)中合成,但由于内毒素的风险,该宿主并不适合用于食品生产。此外,尽管我们前期的研究在酿酒酵母(S. cerevisiae)中成功合成了多种Hb与Mb,但其表达水平远低于毕赤酵母(P. Pastoris)。另外,S. cerevisiae低效的分泌表达能力增加了纯化成本,限制了血红素结合蛋白/酶的工业化规模生产。在V-Hb应用于高细胞密度发酵方面,P. Pastoris由于可以在简单且廉价的碳源中实现高密度培养(细胞干重达150 g L-1以上),因此相对E. coli和S. cerevisiae更具有优势。至于全细胞P450s催化,E. coli是常用于异源表达可溶性P450s的宿主。但是,与E. coli和S. cerevisiae相比,P. pastoris对有机溶剂具有良好的耐受性,并且具有更强大的疏水性化合物生产能力。因此,美国食品药品监督管理局(FDA)批准的公认安全(GRAS)的,且具有强大的蛋白表达和分泌能力的P. pastoris是生产血红素结合蛋白/酶的理想候选菌株。
目前,除P450-BM3外,尽管其他三种血红素结合蛋白(P-Mb、S-Hb与V-Hb)已在P. pastoris中成功表达,但仍有三个瓶颈阻碍这些高活性血红素结合蛋白的高效合成。首先,血红素结合蛋白中珠蛋白组分的低表达水平以及降解问题;其次,酵母血红素生物合成过程中存在的空间隔离现象,血红素合成中间体须多次穿越线粒体膜,导致血红素合成和利用效率较低;此外,血红素生物合成过程中存在多个限速步骤,造成细胞中的血红素供应不足。
针对这些问题,江南大学食品合成生物学与生物制造团队研究人员通过增强P. pastoris底盘细胞中血红素的供给水平,实现了高活性血红素结合蛋白的高效合成。首先,通过考察不同P. pastoris宿主、基因拷贝数、发酵时间等条件对血红素结合蛋白中珠蛋白组分表达的影响,选择了合适的基于甲醇诱导的表达系统(PAOX1),并通过过表达PAOX1转录激活因子(Mit1、Mxr1与Prm1)、敲除蛋白酶(Yps1-1、Prb1与Pep4),强化了珠蛋白的转录和翻译水平并抑制其降解。最终在珠蛋白表达水平强化菌株P1中,P-Mb、S-Hb、V-Hb与P450-BM3的产量分别达到了162.46 ± 11.12 mg L-1、184.35 ± 17.14 mg L−1、32.32 ± 5.94 mg L−1与28.31 ± 5.44 mg L−1。
在珠蛋白组分有效表达的基础上,对P. pastoris胞内血红素生物合成途径进行了系统的改造以提高血红素辅基的供给水平。通过生物信息学分析与荧光蛋白共表达,在P. pastoris中首次验证了血红素生物合成涉及酶类的亚细胞定位:Hem2p、Hem3p、Hem4p、Hem12p与Hem13p定位于细胞质中,而Hem1p、Hem14p与Hem15p定位于线粒体中;并获得了Hem1p、Hem14p与Hem15p三个酶的线粒体定位信号(MLS):Hem1p的MLS位于其N端前52位氨基酸,Hem14p与Hem15p的MLS均位于其N端前61-70位氨基酸之间。通过去除Hem1p的MLS或从细菌中引入可替代的血红素合成关键前体5-氨基乙酰丙酸(ALA)生物合成酶,尝试将ALA的生物合成从线粒体转移到细胞质。结果表明,这些重组菌株中ALA的产量极低。因此,必须将ALA的合成途径保留在线粒体中。随后,通过过表达天然的HEM1基因来强化前体ALA的供给,将ALA的产量提升至100.09 ± 1.29 mg L−1。接着,评估了线粒体酶Hem14p和Hem15p在细胞质中的功能表达。结果表明,MLS截短版本的HEM1471-561与HEM1571-375在胞质中共表达,可将血红素的产量提高41.94%。最后,对重构的血红素生物合成途径进行关键步骤的强化,如利用蛋白支架组装限速酶Hem2p、Hem3p与Hem4p(血红素产量提高90.24%)、替换HEM13天然启动子增强其表达以缓解中间体粪卟啉原Ⅲ积累(血红素产量提高83.45%)以及敲除血红素降解酶Hmx1(血红素产量提高1.66倍),进一步增强了血红素的积累。将这些血红素途径改造策略进行集成后,构建得到最终的血红素供给强化菌株HEME-9,其血红素产量达到2.93 ± 0.27 mg L−1,相对于出发菌株提高了37.58倍。
最后,将最优的珠蛋白表达菌株P1中的策略应用到血红素供给菌株HEME-9中,得到血红素结合蛋白生产菌株P1H9。在血红素供给充足的条件下,P-Mb、S-Hb、V-Hb和P450-BM3的产量分别增加了52.01%、55.43%、1.05倍和1.02倍,达到246.95 ± 19.46 mg L−1、286.53 ± 14.29 mg L−1、66.30 ± 7.05 mg L−1与57.27 ± 6.79 mg L−1。此外,P-Mb、S-Hb、V-Hb和P450-BM3的血红素结合率分别增加了2.87倍、3.67倍、1.07倍与2.04倍,达到60.02 ± 6.98%、79.47 ± 6.72%、25.94 ± 4.36%和61.27 ± 6.86%。另外,P-Mb与S-Hb的比过氧化物酶活性、V-Hb的氧结合能力以及P450-BM3全细胞催化活性分别提高了38.10%、29.31%、85.24% 与7.47倍。此研究结果为P. pastoris中高效合成其他血红素结合蛋白如过氧化物酶或过氧化氢酶等提供了可借鉴的策略。
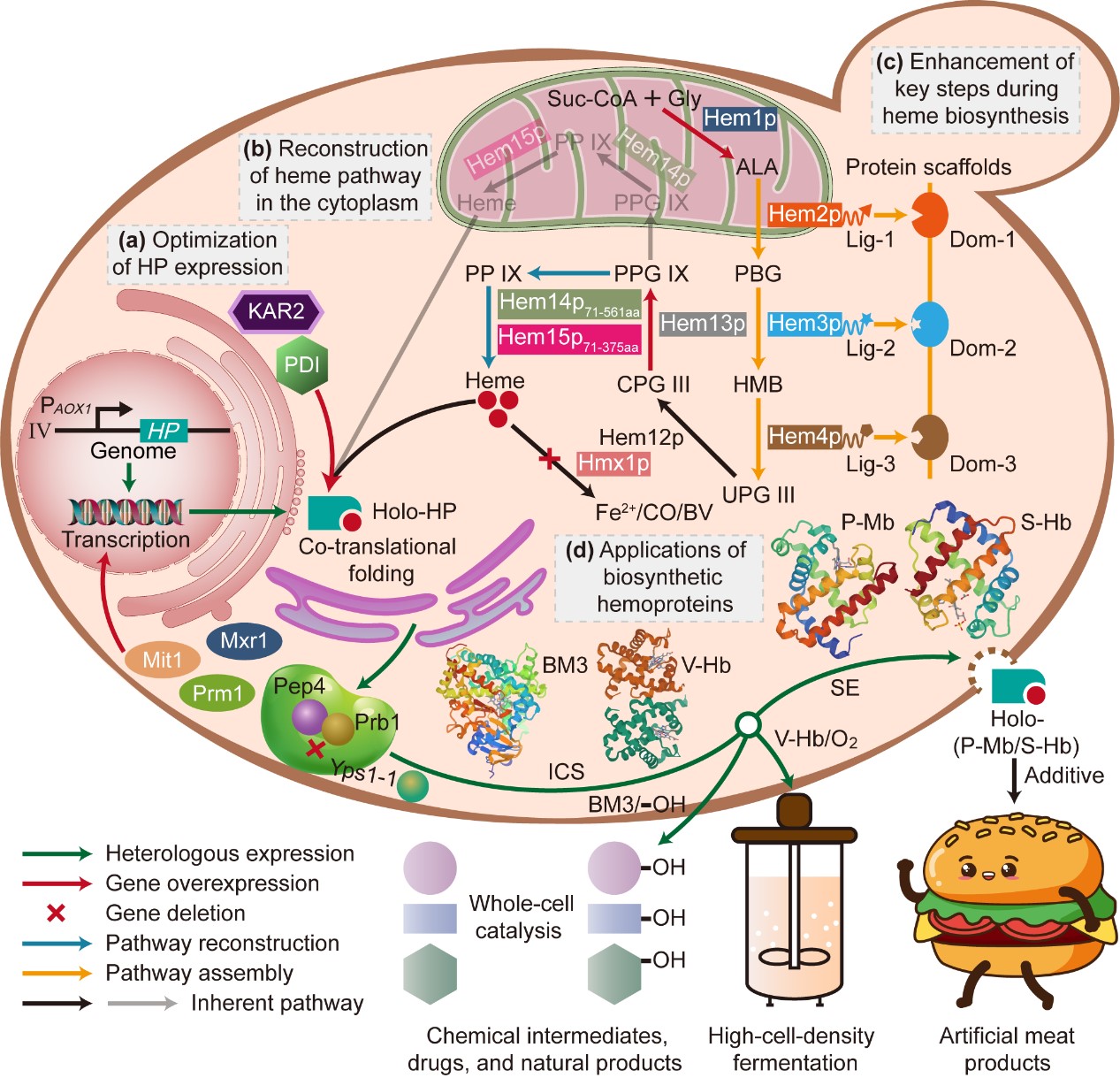
图形摘要
堵国成教授、赵鑫锐副研究员为论文的通讯作者,我校2019级博士生余飞为第一作者。上述研究工作得到了国家重点研发计划(2021YFC2101400)、国家自然科学基金(31900067)和国家轻工业技术与工程一流学科(LITE2018-08)等项目的资助。
