近期,我校生物工程学院饶志明教授团队在L-高丝氨酸的高效制备方面取得重要进展,研究成果“High-efficient production of L-homoserine in Escherichia coli through engineering synthetic pathway combined with regulating cell division”正式发表于Bioresource Technology (IF = 11.4) (https://doi.org/10.1016/j.biortech.2023.129828)。
L-高丝氨酸是生物合成许多必需氨基酸的关键前体并可作为合成L-高丝氨酸内酯和草铵膦等化学产品的潜在平台。生物法相比化学法具有反应条件温和,成本低等优点。而大部分工程菌株中携带的质粒会导致发酵过程不稳定且复杂,同时为避免质粒丢失需要在发酵过程中添加抗生素,这会进一步增加生产成本。因此,有必要开发具有良好L-高丝氨酸产量的无质粒微生物细胞工厂。
目前, L-高丝氨酸生产菌株主要通过沿代谢通路增强碳通量的思路进行构建。另一方面,通过调节细胞分裂的C期和D期可以显著影响细胞形态从而进一步影响细胞密度、质量传递与化学品的生产特性,但通过其来改善微生物的L-高丝氨酸生产性能的相关报道较少。
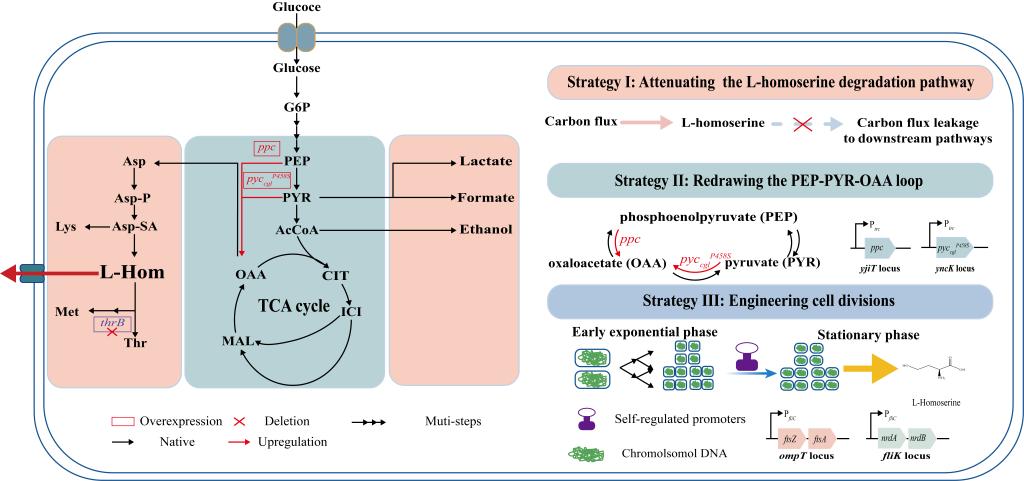
饶志明教授团队针对L-高丝氨酸工程菌株生产过程中可能出现的L-高丝氨酸合成速率随细胞持续生长而降低等问题,采用双重策略改造大肠杆菌高效制备L-高丝氨酸。首先,探究削弱有机酸分支代谢与L-高丝氨酸降解途径对L-高丝氨酸积累的作用。在阻遏L-苏氨酸的合成通路后,HOM5菌株摇瓶发酵36 h 积累50.15 g/L L-高丝氨酸,相比出发菌株提高21.63%。其次,通过重构PEP-PYR-OAA环加强OAA的积累促进 L-高丝氨酸生产。在增加ppc的拷贝数并引入来自谷氨酸棒杆菌的pycP458S cgl后,HOM14菌株的L-高丝氨酸产量升至54.25 g/L,比HOM5的L-高丝氨酸产量增加8.18%。随后考察了细胞分裂与L-高丝氨酸合成的关系,发现细胞分裂缩短的菌株显示出更高的L-高丝氨酸产量。然而,随着发酵后期生物量的持续增长,L-高丝氨酸的合成速率开始放缓并影响最终的产量。因此,引入自我调节启动子改造细胞分裂以协调细胞生长与L-高丝氨酸合成。HOM23摇瓶发酵 36 h积累62.49 g/L的L-高丝氨酸,其也是本研究中工程菌株通过摇瓶发酵达到的最高L-高丝氨酸产量。最后,将该菌株用于5 L发酵罐放大生产。最终菌株HOM23在5 L发酵罐中能够积累101.31 g/L L-高丝氨酸,生产强度达到1.91 g/L/h。其为已报道的无质粒菌株生产L-高丝氨酸所达到的最高产量及生产强度。本研究为生物合成L-高丝氨酸提供了一种绿色、高效的方法并为有价值化学品的大规模合成提供了可能的解决方案。
图形摘要
饶志明教授为论文的通讯作者,我校2021级硕士生刘知非为第一作者。上述研究得到了国家重点研发计划(2021YFC2100900)、国家自然科学基金(32071470)等资助。
近年来饶志明教授团队以合成生物学科学理论为指导,在系统开展高效合成高值化合物细胞工厂构建及产业化方面取得丰硕成果,相关研究成果已发表在Science Advances、Nature Communication、ACS Catalysis、Advanced Materials、Green Chemistry、Metabolic Engineering、Bioresource Technology等本领域权威期刊。
