近期,我校生物工程学院李崎教授团队在胰蛋白酶表达量提升方面取得重要进展,研究成果“Enhanced expression of a novel trypsin from Streptomyces fradiae in Komagataella phaffii GS115 through combinational strategies of propeptide engineering and self-degredation sites modification”正式发表于International Journal of Biological Macromolecules (IF = 8.20) (https://doi.org/10.1016/j.ijbiomac.2023.127382)。
胰蛋白酶是(EC 3.4.21.4)是一种丝氨酸蛋白,能专一性切割肽链中精氨酸或赖氨酸残基,被广泛应用于皮革软化、食品加工、临床诊断和生化检测等领域。微生物产胰蛋白酶具有方便快捷、成本低的特点,但是其存在表达量低、易自降解等问题。因此,需要通过基因工程和酶工程方法提升胰蛋白酶的表达量。
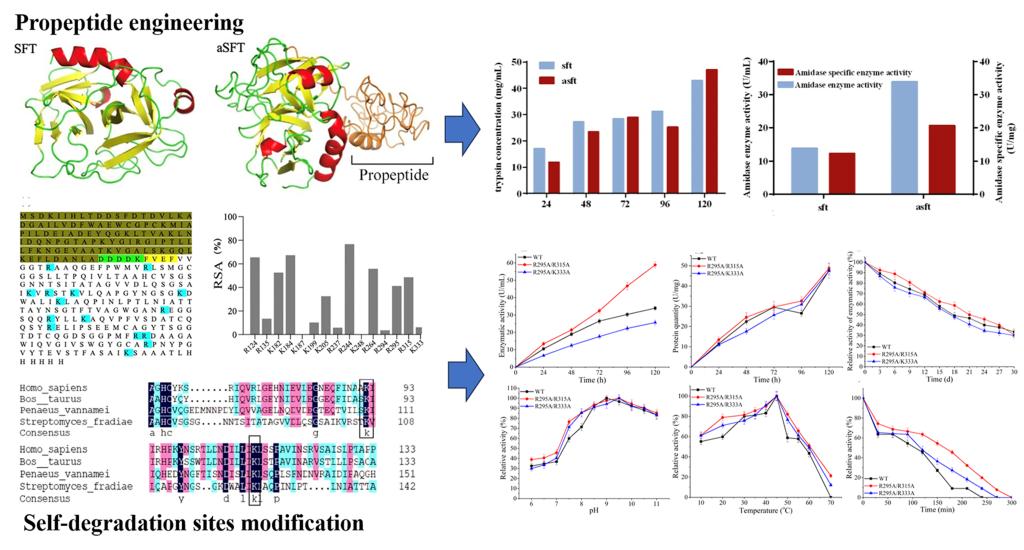
李崎教授团队在前期挖掘得到的弗氏链霉菌来源胰蛋白酶基础上,将融合标签TrxA、非天然肽FVEF和牛源胰蛋白酶前肽VDDDK替换其初始前导肽,发现经前导肽修饰的改造酶aSFT的表达量和比酶活和初始酶相比分别提高了59.3%和40.3%。改造后的胰蛋白酶Km值低于初始酶,说明前导肽的替换使胰蛋白酶底物亲和力有所提高。在此基础上,通过SFT结构中精氨酸与赖氨酸位点的溶剂可及性分析和保守氨基酸序列比对,推测了5 个具有潜在自降解可能的氨基酸并构建了上述位点的丙氨酸突变体。结果发现,突变体R124A、R135A、K295A的酶活与野生酶相比有显著上升,其中R295A突变体的酶活较WT提高了47.5%,且自降解条带明显较少。最后,在摇瓶水平对胰蛋白酶发酵培养基组成和发酵条件进行了优化,优化后的发酵酶活是未优化前的2.55倍。本研究表明前导肽改造和自降解位点修饰是提高胰蛋白酶表达量的有效方法,为胰蛋白酶的生产提供了可能。
图形摘要
李崎教授为论文的通讯作者,钮成拓副研究员为第一作者。上述研究得到了国家重点研发计划子课题(2021YFC2100400)、工业生物技术教育部重点实验室开放课题(KLIB-KF202104)等资助。
