近期,我校生物工程学院饶志明教授团队在L-茶氨酸的高效生产方面取得重要进展,研究成果“Combining protein and metabolic engineering strategies for high-level production of L-theanine in Corynebacterium glutamicum”正式发表于Bioresource Technology (IF = 11.4) (https://doi.org/10.1016/j.biortech.2023.130200)。
L-茶氨酸是一种应用广泛的天然非蛋白氨基酸,广泛用作食品添加剂和精神类药物原料。目前主要采用生物发酵法生产L-茶氨酸,该方法需要效率高和稳定性好的功能酶作为支撑。因此,需要筛选和改造适合L-茶氨酸生产的酶来实现发酵高效生产L-茶氨酸。
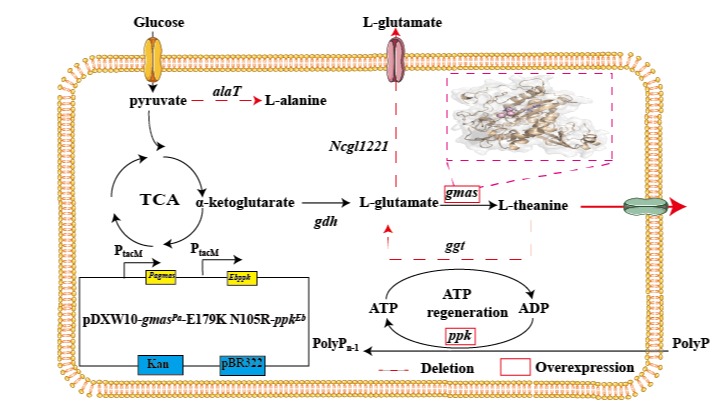
饶志明教授团队针对谷氨酸棒杆菌生产L-茶氨酸过程中的限速酶——γ-谷氨酰甲胺合成酶(GMAS),采用蛋白质工程和代谢工程相结合的方法,建了一株高效产L-茶氨酸的谷氨酸棒杆菌。首先筛选不同来源和计算机辅助药物设计(CADD)旨在提高GMAS的稳定性及催化活力,最终筛选到一个来源嗜氨副球菌双突变体GMASE179K/N105R;在32℃下,GMASE179K/N105R突变体的半衰期从约21 h增加到约48 h,增加了2.2倍。pH值为7和7.5时的半衰期也增加了约20 h,并且使L-茶氨酸产量提高36.61%;通过MD模拟比较了GMAS和突变蛋白的蛋白特征,结果表明,突变后的蛋白对Mg2+的结合力减弱,Mg2+活性增强,酶活性随之增强;通过FoldX进一步分析发现,突变后的蛋白与ATP的结合能较突变前下降了0.38 kJ·mol-1,说明该蛋白与ATP的结合更加紧密,从而提高了酶的活性;从突变体与小分子配体的相互作用来看,突变体E179K通过影响ATP结合来增强酶活性;通过GROMACS进行分子动力学模拟,N105R突变体整体残基的RMSF值降低,其中残基100-200区域大幅减少,表明突变体在局部柔性区域实现了刚性,从而使蛋白质结构更加稳定。其次,敲除ggt基因缓解了L-茶氨酸的降解,敲除参与L-丙氨酸合成的基因alaT和编码谷氨酸输出蛋白的基因NCgl1221旨在增加L-茶氨酸生成的碳通量,过表达ppk基因增强细胞内ATP的产生,获得一株高效生产L-茶氨酸的谷氨酸棒杆菌。最后将该菌株用于5 L发酵罐放大,L-茶氨酸产量为44.12 g/L,糖酸转化率为57.11%,合成速率为1.16 g/L/h,为谷氨酸棒杆菌目前报道的最高L-茶氨酸滴度。本研究为L-茶氨酸的工业化生产提供了一条高效、经济的生物合成途径。
图形摘要
饶志明教授为论文通讯作者,杨套伟副教授和2021级硕士生张迪为本文共同第一作者。上述研究得到了国家重点研发计划(2021YFC2100900)等资助。
近年来饶志明教授团队以合成生物学科学理论为指导,在系统开展高效合成高值化合物细胞工厂构建及产业化方面取得丰硕成果,相关研究成果已发表在Science Advances、Nature Communication、ACS Catalysis、Advanced Materials、Nucleic Acids Research、Bioresource Technology、Green Chemistry、Metabolic Engineering等本领域权威期刊。
